生物支架材料:各種缺損組織都有可能再生!
生物支架材料:各種缺損組織都有可能再生!
發(fā)布日期:2015-11-17 09:33
創(chuàng)傷、疾病、遺傳、衰老等原因可能造成組織、器官缺損或功能障礙,我國(guó)這一類型的患者人數(shù)位居世界各國(guó)之首。生物學(xué)領(lǐng)域的科學(xué)家一直致力于攻克修復(fù)創(chuàng)傷、組織再生甚至器官再生的難題。 最近幾年,由中科院遺傳發(fā)育所領(lǐng)銜的中國(guó)科學(xué)院與再生醫(yī)學(xué)戰(zhàn)略性先導(dǎo)科技專項(xiàng)的“人工組織器官構(gòu)建”項(xiàng)目,在再生修復(fù)領(lǐng)域取得了一系列技術(shù)突破。干細(xì)胞與再生醫(yī)學(xué)先導(dǎo)專項(xiàng)是中科院“A類先導(dǎo)”中最先啟動(dòng)的項(xiàng)目之一,戴建武研究員帶領(lǐng)團(tuán)隊(duì),利用生長(zhǎng)因子控釋技術(shù)改造生物支架材料,研制出了具有誘導(dǎo)組織再生能力的智能生物材料。這些智能生物材料攜帶的活性功能成分(通常包括生長(zhǎng)因子或干細(xì)胞等),能主動(dòng)對(duì)機(jī)體的再生過程產(chǎn)生影響。 生物支架材料 為組織再生提供空間 生物機(jī)體本身各種組織都具有一定的再生能力,創(chuàng)口處的組織中和血液中存在組織再生所需的干細(xì)胞,科學(xué)家們需要提供一個(gè)有利于細(xì)胞黏附、增殖、分化的環(huán)境,也就是支架材料。 由于支架材料要植入機(jī)體內(nèi),材料基質(zhì)的選擇就顯得非常重要。項(xiàng)目組選擇了人體最重要的外基質(zhì)——膠原蛋白,研發(fā)出一批支架材料產(chǎn)品,可引導(dǎo)多種組織再生包括神經(jīng)、肌腱等的有序再生。一小塊膠原薄膜縫合到切除舌癌的創(chuàng)口處,三四個(gè)月后,再生的組織已基本填滿了缺損的部分。除了提供再生空間,膠原支架還可以引導(dǎo)組織再生,例如神經(jīng)外周神經(jīng)損傷后,神經(jīng)再生比其它組織再生要慢,損傷部位纖維組織生長(zhǎng)較快而阻礙神經(jīng)再生,在創(chuàng)面嵌入一塊膠原膜可起到屏蔽纖維化組織生長(zhǎng)而引導(dǎo)神經(jīng)再生的作用。 生長(zhǎng)因子緩釋技術(shù) 高效主動(dòng)定向誘導(dǎo)組織再生

無菌的生長(zhǎng)因子制備間

生產(chǎn)的生長(zhǎng)因子可通過潔凈間的傳遞窗向外傳遞
然而,盡管利用支架材料可以支持一定程度的組織再生,但支架材料本身不具有誘導(dǎo)組織再生的能力。換句話說,支架材料只是搭了臺(tái),但要想請(qǐng)得動(dòng)細(xì)胞唱再生修復(fù)這出“戲”,還需要生長(zhǎng)因子等能誘導(dǎo)組織再生的活性信號(hào)分子出馬。生長(zhǎng)因子是一類具有調(diào)節(jié)細(xì)胞生長(zhǎng)、分化等特性的細(xì)胞因子,通過與特異的、高親和的細(xì)胞膜受體結(jié)合,調(diào)節(jié)細(xì)胞生長(zhǎng)及其他細(xì)胞功能。生長(zhǎng)因子用于臨床最大的問題,就是會(huì)在創(chuàng)面擴(kuò)散而被血液稀釋。不僅會(huì)造成非常大的消耗量,還存在風(fēng)險(xiǎn)——隨血液到處擴(kuò)散的生長(zhǎng)因子,可能在別處誘導(dǎo)不必要的再生(副作用)。
遺傳發(fā)育所再生醫(yī)學(xué)團(tuán)隊(duì)通過改造生長(zhǎng)因子的分子結(jié)構(gòu),制備了融合膠原結(jié)合區(qū)(CBD)的生長(zhǎng)因子,利用一節(jié)短肽將其“拴”在支架上;同時(shí),當(dāng)生長(zhǎng)因子被細(xì)胞表面受體識(shí)別時(shí),又能從膠原膜上釋放出來。這樣,在體內(nèi)損傷修復(fù)環(huán)境中,保證了生長(zhǎng)因子不會(huì)從材料上“掉下來”,在組織中擴(kuò)散,有效地控制其在病灶處釋放;且能提高生長(zhǎng)因子的局部治療濃度,大大降低消耗。
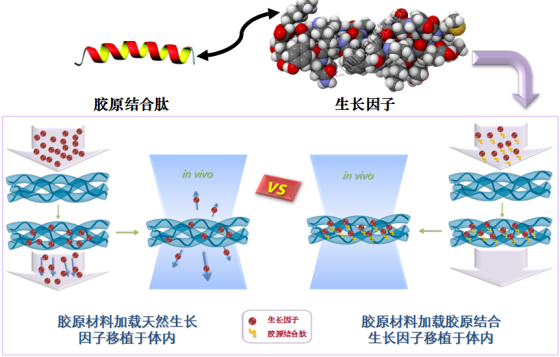
具有世界領(lǐng)先的生長(zhǎng)因子控釋技術(shù)已獲得多項(xiàng)國(guó)內(nèi)專利,并獲得國(guó)際專利。
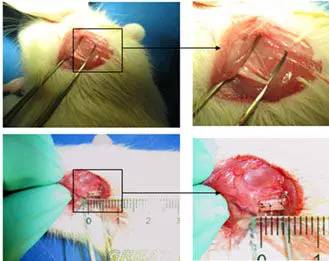
基于這種生長(zhǎng)因子緩釋技術(shù),項(xiàng)目組已經(jīng)研制出了多種智能生物材料,在骨組織、外周神經(jīng)組織、膀胱組織、心肌組織等多種組織的再生上,都取得了有效的進(jìn)展。 交通事故、腫瘤手術(shù)等有時(shí)會(huì)造成神經(jīng)損傷,比如人們常說的“口歪眼斜”就是面部神經(jīng)損傷的典型表征。我國(guó)每年新增這類患者約40-60萬例。微小的損傷,外周神經(jīng)本身即可修復(fù);而對(duì)于較長(zhǎng)距離的損傷,其再生能力就有限了。項(xiàng)目組研制的有序膠原纖維和膠原導(dǎo)管,能夠較好地恢復(fù)遠(yuǎn)距離(3.5cm以上)面神經(jīng)的功能。 除了支架材料和生長(zhǎng)因子,干細(xì)胞是再生醫(yī)學(xué)的另外一個(gè)核心要素。干細(xì)胞是具有多向分化潛能的未分化或低分化的細(xì)胞;在上述生長(zhǎng)因子引導(dǎo)之下,分化出功能細(xì)胞重建所需組織。除此之外,科學(xué)家們也在探尋更多樣的干細(xì)胞修復(fù)方法。比如靜脈注射,將干細(xì)胞隨血液輸送到病灶處進(jìn)行修復(fù)。遺傳發(fā)育所的再生醫(yī)學(xué)科研團(tuán)隊(duì)正在探索利用干細(xì)胞治療塵肺病的新療法。 塵肺是以肺組織纖維性病變?yōu)橹鞯募膊。L(zhǎng)期吸入粉塵所致;中國(guó)患?jí)m肺病人數(shù)居世界之首,已患病人數(shù)100余萬例,并且沒有特效治療方法。目前治療方法之一是大容量肺灌洗,但肺灌洗對(duì)初級(jí)的塵肺有效,且不能延緩或控制纖維化進(jìn)展。遺傳發(fā)育所團(tuán)隊(duì)研究認(rèn)為,大量的肺灌洗后,肺部會(huì)留下很多新鮮的創(chuàng)面,如若將干細(xì)胞與肺灌洗結(jié)合,可以讓干細(xì)胞直接入肺參與組織重建。初步實(shí)驗(yàn)證明,此法確實(shí)對(duì)于肺缺氧、炎癥等具有很大的改善作用。而且,相對(duì)于干細(xì)胞靜脈輸入,干細(xì)胞灌洗是一個(gè)外循環(huán)過程,安全性更高。 項(xiàng)目組還有一項(xiàng)重要的取得階段性進(jìn)展的工作,是在臨床級(jí)別間充質(zhì)干細(xì)胞認(rèn)證方面的工作, 中科院動(dòng)物研究所的北京干細(xì)胞庫(周琪研究員課題組)承擔(dān)了干細(xì)胞標(biāo)準(zhǔn)化研究的任務(wù)。間充質(zhì)干細(xì)胞是一類存在于多種組織(如骨髓、臍帶血和臍帶組織、胎盤組織、脂肪組織等),具有多向分化潛力的成體干細(xì)胞,具有來源廣泛、免疫原性低等特點(diǎn)。這為干細(xì)胞的臨床研究提供了堅(jiān)實(shí)的基礎(chǔ)。不過,目前我國(guó)對(duì)于干細(xì)胞研究尚持比較謹(jǐn)慎的態(tài)度,尤其對(duì)臨床使用管理十分嚴(yán)格。對(duì)于干細(xì)胞再生修復(fù)的爭(zhēng)議,戴建武研究員認(rèn)為主要還是對(duì)安全性的擔(dān)憂:干細(xì)胞是非常具有前景的生物醫(yī)療手段,但由于其全能性,進(jìn)入人體后是否會(huì)出現(xiàn)計(jì)劃外的分化,尤其是是否會(huì)發(fā)生癌變,現(xiàn)階段還沒有足夠的實(shí)驗(yàn)支撐,必須嚴(yán)謹(jǐn)?shù)貙?duì)待。 智能生物材料未來的產(chǎn)品轉(zhuǎn)化,趨勢(shì)是由簡(jiǎn)單到復(fù)雜;從最開始使用單一支架,或一種干細(xì)胞,一種生長(zhǎng)因子引導(dǎo)再生到兩兩結(jié)合,最終三者相結(jié)合,即有可能完成體外誘導(dǎo)培養(yǎng)成完備的組織器官,如同汽車零件,達(dá)到再生修復(fù)的“私人定制”。

